
医学界一直致力于对人类大脑的深入研究,以期更好地理解其结构和功能,开创疾病预防和治疗新策略。类器官技术的出现为这一领域带来了前所未有的新突破。近日,科学家们发现了在全人源细胞培养系统中可以开发功能性小脑类器官的研究平台,相关研究成果刊发在《Cell Stem Cell》(影响因子IF=23.90)上。这个首次在体外培养出的小脑类器官模型,有望为神经科学和个性化医疗带来重大变革,或将成为加速相关疾病药物研发的助推器。
小脑(cerebellum, CB)研究一直备受关注。
已经有研究表明小脑在协调机体运动、维持平衡中发挥着关键作用,此外还包括语言、空间处理、工作记忆、情绪处理等认知功能中产生的影响。
与其他哺乳动物相比,人类的小脑具有神经元亚型比例改变和小叶复杂性增加这两大主要特征。一般认为小脑疾病(如Dandy-Walker畸形、小脑蚓部发育不良、髓母细胞瘤、自闭症和共济失调等)与一些人类特有的神经祖细胞有关。
这些小脑疾病通过在小鼠模型中进行研究,但是小鼠模型无法完全体现人类小脑细胞多样性以及功能特征,也无法完全重现人类疾病的各种表型。因此,迫切需要开发一种可以产生功能性小脑神经细胞的体外培养系统,填补研究模型的空缺。
近日,美国南加州大学Keck医学院Giorgia Quadrato团队开发了一种人类小脑类器官(hCerO),可以让包含浦肯野细胞在内的功能性小脑细胞,在体外人源三维环境中长期健康存活和成熟。相关成果[1]发表在Cell Stem Cell杂志上。

该研究建立的小脑类器官模型,解决了该领域的长期挑战。这也是首次在全人源系统中成功培育出功能神经元分子和电生理特征的浦肯野细胞,为研究人类小脑发育、稳态和疾病提供了一个全新的视野和平台。
01
首个小脑类器官
提升人脑研究新平台
小脑是重要的躯体运动调节中枢之一,虽然仅占大脑总体积的10%,却包含有大脑神经元数量的50%-80%。
在所有的哺乳动物中,小脑起源于菱脑原节1号区域(rhombomere 1, r1),r1区域又包含了脑室区(ventricular zone, VZ)和菱唇(rhomboid lip, RL)。脑室区可生成γ-氨基丁酸能神经元(GABAergic neuron,一类释放γ-氨基丁酸的神经元),如浦肯野细胞(Purkinje cell);而菱唇负责生成谷氨酸能神经元(Glutamatergic neurons,一类释放谷氨酸的神经元),如颗粒细胞(granule cell)。
人类小脑中有来自菱唇(Rhombic lip)的特有神经祖细胞,而菱唇的异常发育与多种小脑疾病有关,包括Dandy-Walker畸形、小脑蚓部发育不良,以及最常见的转移性儿童脑肿瘤髓母细胞瘤,其他小脑疾病(包括自闭症、小脑共济失调)与小脑皮层主要输出神经元浦肯野细胞(Purkinje cell)的退化有关。
以上这些疾病研究主要在动物实验中进行,但小鼠模型无法完全体现人类小脑细胞多样性以及功能特征(主要是人类小脑具有神经元亚型比例改变和小叶复杂性增加这两大主要特征),也无法完全重现人类疾病的各种表现。因此,脑科学家们迫切需要开发一种全人源细胞培养系统,能够产生功能性浦肯野细胞。
随着类器官技术的不断成熟及科学家们对小脑研究的孜孜以求,南加州大学的科研团队首次开发出人类小脑类器官(hCerO),成功破解了该领域的长期挑战。这也是首次在全人源系统中成功培育出功能神经元分子和电生理特征的浦肯野细胞。

△ 该实验的图形概要。
小脑从菱脑原节1号区域(R1)的最喙部区域发育而来,R1是发育中的神经管的一个区域,位于峡部组织中心的尾部,峡部组织中心定义了中脑-后脑的边界。研究人员构建了一个基于峡部组织者发育所需信号分子调节的类器官方案。
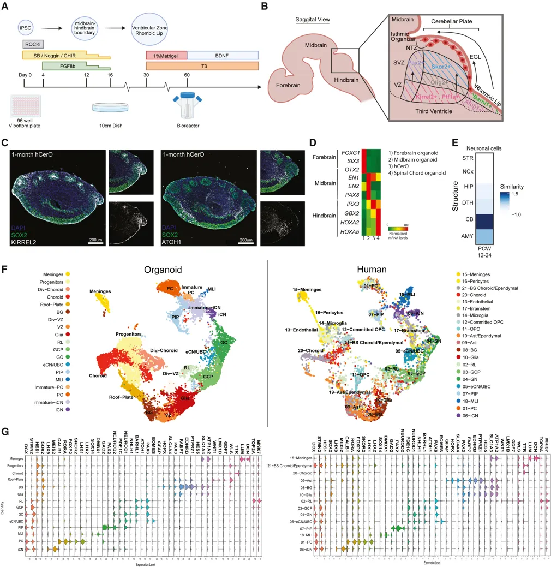
△ 人小脑类器官(hCerOs)可重复地产生人CB的细胞多样性。
这个小脑类器官的出现,填补了过往研究模型的缺失,可以重复产生人类小脑的细胞多样性。包括在此研究之前从未在体外生成的人类特异性菱唇祖细胞群。
研究人员对来自3个 2 个月大的类器官的 14,947 个细胞进行了单细胞 RNA 测序 (scRNA-seq),并通过将差异表达基因的特征与人类发育中小脑的内源性细胞类型的预先存在的单细胞数据集进行比较,系统地对簇进行了分类。最终根据开发人脑的参考数据集进行了基准测试,得到一项独立分析的证实,这将有助于构建人脑类器官图谱。

△ hCerOs 显示有组织的层状分层,让人联想到外部颗粒细胞层 (EGL) 和浦肯野细胞层 (PCL)。
经过培养的2个月大的hCerO形成独特的细胞结构特征,包括层状组织层,并在抑制性和兴奋性神经元之间建立功能连接,显示协调的网络活动,可以形成神经功能网络。
而经过长期培养hCerO可以使浦肯野细胞健康存活和成熟,增加hCerO中兴奋性和抑制性神经元之间的功能连接水平。这些浦肯野细胞显示了功能性神经元的转录组学和电生理特征,解决了该领域的长期挑战。
总体而言,该研究建立了一个类器官模型,这是首次在体外全人源细胞培养系统中,成功培养出具有功能性的浦肯野细胞。这一创新突破,解决了脑科学领域的一个重大技术难题,为研究人类小脑发育、稳态和疾病提供了一个全新的平台。为进一步认识小脑进化生物学,研究与菱唇发育相关疾病,重现小脑与其他脑区的连接,加速脑病相关药物研发,提供了一种有效的研究工具。
02
从疾病研究到药物测试
类器官引领再生医学发展
模拟复杂的人脑结构并建立体外研究模型并非易事。近年来,通过多能干细胞在受控培养环境中生成复杂的大脑类器官(Brain Organoids)为理解人脑发育的机制开辟了新的途径。利用iPS干细胞(或组织)衍生大脑类器官,刷新了再生医学和遗传学的过往认知。
从干细胞衍生的单个神经花环中生产人类大脑类器官,到iPSC衍生人脑皮质-运动类器官组装体,科学家们对人类大脑的体外模型研究已近乎“炉火纯青”的程度,这些类器官能够在很多方面模拟真实器官的生理和病理状态,为医学研究、药物开发和疾病治疗提供了全新的平台。

△ 芝麻大小的类脑类器官是在实验室中从人体细胞中培养出来的。他们正在提供对大脑的见解,并揭示可能导致某些人自闭症的差异。
随着类器官技术的飞跃发展,人类可借此体外模型,颠覆对过往研究的认知,探索更深更广的再生医学未知领域,增添更多面对复杂的未知疾病的底气。
创新的类器官模型能够模拟大脑的结构和功能,包含多种神经元和胶质细胞类型,为研究大脑发育、神经退行性疾病和心理健康问题提供了有力的工具。未来,不断精进的类器官有望在疾病模型、药物筛选、个性化医疗、神经康复研究等方面发挥作用,为大脑相关疾病带来有效的治疗手段,改善患者生活质量。
Write in the last
写在最后
类器官技术的成熟,为解开人类大脑未知之谜带来了前所未有的机会。这种高仿真、高通量的疾病研究模型优势,让类器官在疾病机制、药物测试、基因编辑、新药研发等领域均显示出巨大的潜能,推动现代医学和再生医学的进步。相信在科学家的科研探索之下,以干细胞和类器官技术为代表的再生医学,将在对抗疾病和提升健康水平方面发挥更多潜力,书写更多生命“奇迹”。
参考文献:
[1] Alexander Atamian ,Marcella Birtele,et,al.Human cerebellar organoids with functional Purkinje cells,JANUARY 04,2024,Cell Stem Cell,DOl: https://doi.org/10.1016/.stem.2023.11.013