
近日,国内首个用于肠癌无创早筛的产品“常卫清”获得国家药品监督管理局批准上市(注册人名称:杭州诺辉健康科技有限公司),立刻引起了行业的广泛关注。
常卫清是中国第一个使用多靶点粪便FIT-DNA技术,检测粪便样本中与肠癌发生有密切关系的多种DNA和蛋白的分子指标(包括基因突变、基因甲基化变异和血红蛋白),来综合判断受检者患肠道癌前病变(主要为进展期腺瘤)及肠癌风险的筛查产品。
该产品所属的肠癌分子诊断领域近几年竞争非常激烈。此前已经有多个其他厂家的产品进行了注册,例如深圳晋百慧的“miR-92a检测试剂盒”、康立明的“SDC2甲基化检测试剂盒”、博尔诚的“Septin9甲基化检测试剂盒”等。这些产品被药监局批准的预期用途都是“辅助诊断”,但是常卫清选择了“筛查”这样一条跟之前做法大不相同的应用路径。
抛开其他,接下来我们仅从药监局公开的常卫清审评报告,并结合此前药监局公开的其他辅助诊断类产品审评报告,以对比的方式来分析早筛产品的审批特点。不当之处,敬请指正。
一、产品预期用途
常卫清是一个商品名,它正式的产品名称是:
KRAS基因突变及 BMP3/NDRG4 基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)
这可能是目前我见过的名字最长的体外诊断试剂产品了。从名字里我们大概看出这是一款4个靶标联合检测的试剂盒,使用荧光PCR法检测3个分子标志物,使用胶体金法检测便隐血。

产品获批的预期用途如下:
本试剂盒用于体外定性检测人粪便样本中的KRAS基因突变(包括但不区分 G12D、G12A、G12V、G12S、G12R、 G12C、G13D)、BMP3 和 NDRG4 基因甲基化及血红蛋白,各个指标的检测值通过“KRAS 基因突变及 BMP3/NDRG4 基因甲基化和便隐血联合检测分析软件”计算综合评分,用于对肠镜依从性差的结直肠癌高风险人群的筛查。
综合评分大于或等于阳性判断值的样本为阳性,表示受检者体内可能有结直肠癌和/或进展期腺瘤,需要进一步接受肠镜检查;反之,如果综合评分低于阳性判断值,表示受检者体内有结直肠癌和/或进展期腺瘤的可能性低,但并不能完全排除疾病风险。鉴于受试者为高风险人群,因此在必要时仍应建议进行肠镜检查。
该产品适用人群为年龄40-74岁的结直肠癌高风险人群(高风险人群判定参照中国结直肠肿瘤早诊筛查相关专家共识)。本产品不能替代肠镜,不能用于普通人群的肿瘤筛查,临床诊断过程中不应以本产品检测结果作为临床诊断的唯一依据。
为了更加深入的对这一款产品进行了解,我们简单地选择了另一款同样由NMPA公开审评报告的肠癌辅助诊断分子检测产品-康立明的“人类SDC2 基因甲基化检测试剂盒(荧光PCR法)”,商品名“长安心”,将其二者进行对比,看看有哪些差异。
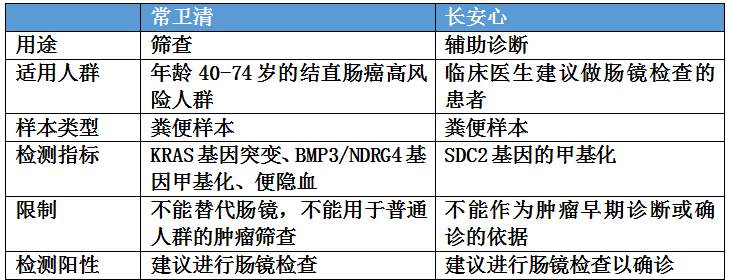
长安心用于肠镜的辅助诊断,也就是为临床医生诊断有疑似肠癌症状的患者提供辅助性证据,发挥鉴别诊断作用,所以既不能单独排除也不能确诊肠癌。我们也同时注意到长安心的临床预期用途里面没有包含进展期腺瘤,显示没有足够数据支持针对癌前病变的检测性能。常卫清则用于40-74岁高风险人群的筛查,这其中包含具备肠癌高风险但是没有临床症状的人群,从中区分健康人和可能患肠癌以及进展期腺瘤的个体,发现隐匿病例,进入后续诊疗流程。
其中,对于常卫清适用高风险人群的判断,《中国结直肠肿瘤早诊筛查策略专家共识》有如下的定义:

二、检验原理
常卫清基于荧光 PCR 技术和胶体金技术,对粪便样本中可能含有的脱落肠道癌变细胞中的变异核酸物质及粪便中可能潜隐的血红蛋白进行检测。
长安心用于体外定性检测人粪便样本中SDC2 基因的甲基化情况。
对于基因甲基化标志物,二者均采用亚硫酸盐处理后对C和U的差异进行检测,在这一点上,我们也期待能早日看到其他方法学的甲基化检测产品上市。
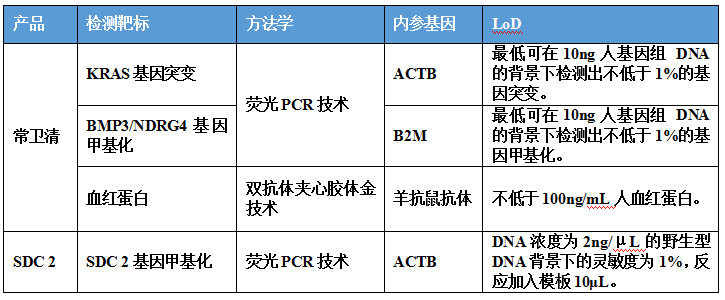
三、分析性能研究
常卫清分析性能评估内容包括准确度(阴/阳性符合率)、精密度、分析灵敏度、分析特异性的研究。便隐血检测部分进行了钩状效应的研究。
常卫清分析性能部分的具体研究方法和结论不再赘述,仅列举与长安心相比值得注意的几点如下:
1.长安心在干扰研究中,发现黄连素(9.23mg/ml)对检测结果有影响,因此提示患者取样前1天应注意勿服用药物黄连素。常卫清也验证了包括黄连素(6mg/g)在内的干扰物质,未发现药物和饮食会对检测结果造成影响;
2.常卫清进行了完整的样本稳定性研究和便型研究,尤其是“布里斯托大便分型规则”,属于新的知识点,有兴趣者可以自行查询;
3.样本的采集和保存方面,常卫清取样5g,在常温下可保存7天;长安心取样1.5~10g,3天内寄送至检测机构。
四、阳性判断值
常卫清阳性判断值的研究采用临床来源粪便样本。共选取628例样本,其中结直肠癌269例、进展期腺瘤64例;非进展期腺瘤24例、肠息肉样本20例、正常人251例。最终根据临床对于检测灵敏度和特异性的需求分析,判定检测综合评分≥165时判断为阳性;综合评分<165时判断为阴性。
因此,该产品的阳性判断值为:
当综合评分≥165时,该样本的检测结果为阳性,当综合评分<165时,该样本的检测结果为阴性。
长安心阳性判断值的研究采用临床来源粪便样本。共选取465例样本,其中结直肠癌患者120例、腺瘤(≥10mm)76例、肠息肉样本(<10mm)31例、肠炎样本24例、胃炎样本6例、胃癌样本18例、胃息肉样本1例,神经内分泌瘤样本3例、肝癌和肠道脂肪瘤样本各1例、正常人184例。
五、临床评价
为了验证常卫清的筛查预期用途,诺辉开展了一项注册临床试验Clear-C,这项研究被称为国内首个癌症早筛人群前瞻性大规模注册临床试验。此前诺辉也在CSCO学术年会上对Clear-C的结果数据做过公开发布,这次审评报告的公开内容又从另一个视角给了我们更多的信息。
以下是这项研究的一些基本信息:
1.受试者人群
结直肠癌高风险人群(高风险人群的判定参照中国结直肠肿瘤早诊筛查相关专家
共识)
2.入组方式
前瞻性入组+回顾性入组
3.比对方法
金标准:肠镜和/或病理检查
4.临床单位
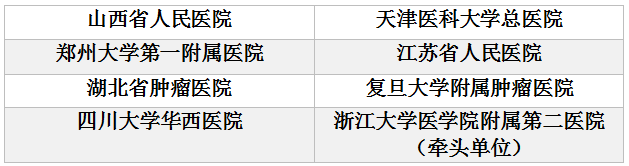
这里值得一提的是临床单位的选择,可以看到很多精心考虑的地方。一是中心数量多,这在目前以注册为目的申请中,很少能见到有产品选择了这么多家中心进行临床试验;二是地域代表性好,临床单位分布于东部、西部和中部,覆盖全国8个省/直辖市;三是有综合性医院,也有肿瘤医院,有不同医疗机构代表性。
整个临床试验按照目的不同,可以分成以下3个部分:
筛查用途的验证(前瞻性研究)
检测性能的验证(前瞻+回顾研究)
各靶标准确性的验证
(1)筛查用途的验证
为了验证常卫清的筛查预期用途,本次临床试验前瞻性入组了4,245例受试者,受试者符合预期用途中定义的高风险人群。在入组时这些人的最终诊断结果还是未知的,还原了真实的筛查应用场景,最大程度地消除了偏倚。
在这4,245名受试者中,最终经金标准确诊为肠癌的患者186例,确诊为进展期腺瘤的患者375例。受试者分布情况如下图所示:
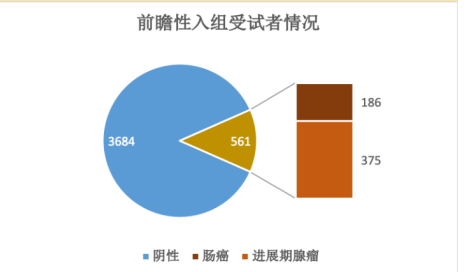
我们也可以根据这次抽样,推断出适用人群(高风险人群)中肠癌和进展期腺瘤的患病率:
结直肠癌患病率 = 186/4245 = 4.38%;
进展期腺瘤患病率 = 375/4245 = 8.83%。
这两个数据的得出,相当于完成了一次高风险人群中肠癌和癌前病变的患病率调查,已经赋予这个研究特别的意义。
对肠癌和进展期腺瘤筛查用途的验证,常卫清基于入组人群也表现了出色的性能,肠癌的筛查灵敏度达到了91.94%,进展期腺瘤的筛查灵敏度达到了63.47%,均显著优于便隐血检测,也优于其他粪便DNA检测试剂的临床试验结果。
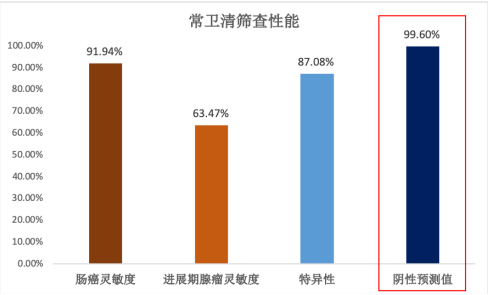
值得一提的是,无论对常卫清这样的筛查试剂,还是其他类似分子方法的辅助诊断产品来说,均存在目标高风险人群肠镜依从性差的特点,检测结果为阴性的患者再行肠镜的依从性进一步降低。因此,如果此类产品假阴性的比例过高,可能导致较多的结直肠癌患者因漏检而贻误治疗。
诺辉使用了阴性预测值(NPV)来评价这方面的应用价值。阴性预测值指待评价筛查试剂判为阴性的受试者中,真正未患病的人所占的比例。
结果显示,常卫清对结直肠癌的阴性预测值达到了99.6%(95%CI:99.2%,99.7%),也就是说,因为它检测为假阴性而导致漏检的比例降到了极低,表现出优异的早筛实用价值。
当然,我们注意到审评报告中仍然对此作了提醒,尽管这一风险在检测为阴性的受试者中发生的概率是4.4‰,为尽力消除该风险,产品说明书仍然要明确标注:本产品检测结果为阴性时并不能完全排除疾病风险,在必要时仍应建议进行肠镜检查。
(2)检测性能的验证
前瞻性研究的优点包括:还原真实应用场景,得到真实的患病率,各方面的偏倚较小等。上一部分描述的前瞻性研究也很好地验证了常卫清的筛查价值。
但是前瞻性研究也有一些不足,如真实世界中发病率较低的疾病会导致阳性入组比例相对偏低。为了进一步验证常卫清针对结直肠癌的临床性能,本次临床试验还回顾性地纳入了不同分期结直肠癌患者419例,以及其他消化道疾病患者和其他癌症患者94例,将这部分回顾性样本和前面前瞻性研究的样本综合在一起,通过与金标准比较,评价常卫清的检测灵敏度和特异性。
在前瞻性样本基数和样本多样性的基础之上,再增加这部分回顾性样本做综合研究,一方面进一步放大了阳性和阴性样本的数量,另一方面是有针对性地选择自一些不同分期的肠癌病例和不同类型的干扰病例做补充,使样本的分布更均匀、对总体特征的反映更全面,据此得到的性能参数将更为稳定。
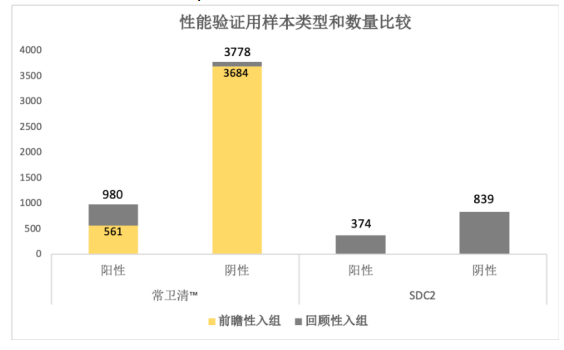
下图是常卫清与长安心的检测性能验证使用的样本类型和数量的比较。
作为诊断试验研究的长安心,临床试验共选择性入组阳性样本374例,阴性样本839例(含肠道正常人群288例),共1,213例。
与之相比,作为筛查研究的常卫清临床试验入组的样本数量要大得多:入组结直肠癌高风险人群4,758例,最终结果为阳性样本例数980例,阴性例数3,778例。
尽管二者预期用途和应用场景有差别,以下仍然通过将常卫清与长安心共同呈现的形式,观察两家产品对于结直肠癌检测的性能特点。
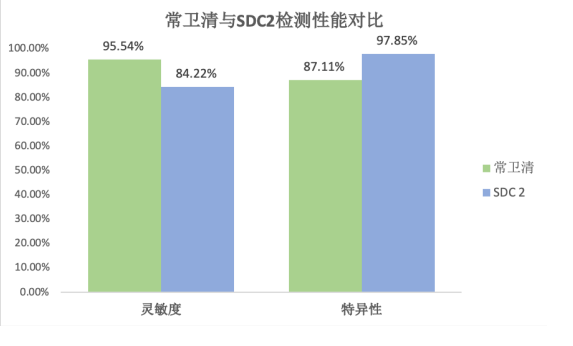
相对而言,筛查产品特别是肠癌筛查的产品,应避免漏检,从而需要较高的灵敏度;辅助诊断产品,需要从各种干扰病例中发挥鉴别诊断的作用,从而更注重特异性,由于长安心临床试验是选择性入组,研究人群中阴性比例较低,与筛查的实际应用场景有显著差别,这会造成特异性结果与临床实际情况发生较大偏倚。
总体而言,两款产品在性能上正好是一个灵敏度更优,一个特异性更高,分别对应于自己的预期用途。
(3)各靶标检测准确性的验证
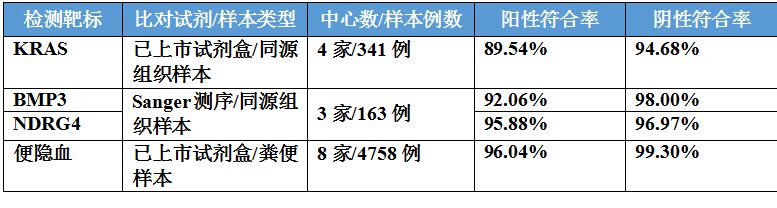
由于常卫清的试剂盒是一个联检产品,包含了4个子试剂盒,针对这4个子试剂盒各自靶标的检测准确性,Clear-C也进行了验证。
这部分验证选择病例的方式值得注意,KRAS和两个甲基化分别为4家和3家临床中心中所有能够获得合格组织样本的肠癌患者,便隐血则为全部8家中心中的所有样本。从准确性验证的试验设计中,可以看到研究的科学性、规范性和控制偏倚的思维。
下表列出了各靶标准确性研究的基本信息和结果:
六、总结与展望
我国当前肠癌的检测现状,存在高风险人群基数大、欠缺有效的筛查和管理手段,同时肠镜预约难、患者依从性差的特点。此前康立明、博尔诚等公司开发的甲基化检测产品等,都是作为辅助诊断产品获批,用于肠镜检查的辅助诊断手段,为临床诊断提供了更多样化的信息。但是这些辅助诊断手段在临床上既不能单独使用,也不能作为肠癌早期诊断或者确诊的依据。
但市场也迫切需要对于肠癌和癌前病变(进展期腺瘤)具有更好敏感性的筛查手段,在更为前置的窗口期,筛选出更高患病风险的群体进入到肠镜诊断,实现早期患者的及早预防和治疗,为肠癌的有效防治赢得宝贵时机。常卫清即着眼于这一领域,凭借联检产品具有的综合性能优势,应用于高风险群体的筛查。
从前文对审评报告内容的解读中,可以看到诺辉为申报这张“早筛第一证”背后所做的大量工作。常卫清的获批,不仅在临床层面开辟了新的路径,在技术、注册审批和市场等方面,也都有其标志性意义。
首先,从产品使用技术角度,它包含了三种类型的肿瘤标记物:血红蛋白、基因突变和甲基化。单靠血红蛋白免疫检测,技术成熟但是灵敏度不尽如人意,所以通过基因突变或者甲基化提高肿瘤早筛检出率,既是近年基础研究的热点,也是产业转化的热门赛道。常卫清基于多靶点联合检测技术获批上市,为从业者提供了极大的参考价值,后续无论选择甲基化技术还是联合检测技术,临床和监管部门对进步技术的开放合作是可以预见的。
其次,从产品注册申报角度,常卫清开展了国内首个前瞻性、大规模、多中心的注册临床试验(Clear-C)来支持其注册申报,可以窥见早筛用途的注册临床设计框架,以及入组要求、终点指标、样本估算、多中心分布等实际落地考量。
再次,从产品的监管审批来看,它是迄今唯一进入国家创新医疗器械审批通道的肠癌无创早筛产品,从2018年5月通过创新审批,到2020年11月获批上市,2年半时间完成多中心前瞻性大样本量的临床试验和技术审评。申请企业的执行效率和监管部门的审批效率,都给行业呈现了一个优质的对标榜样,可供后来者学习。
最后,从产品所在市场角度,近十年肿瘤基因检测市场发展如火如荼,围绕“早筛、早诊、早治”,定位早治的用药指导产品获批最多,定位早诊的辅助诊断产品也有多个癌种多个产品获批。常卫清定位早筛,作为国内首个获批产品,标志着千亿早筛市场正式迈入新时代。